KRAS是最常见的致癌驱动基因之一👛👩🦯➡️,大约25%的非小细胞肺癌(NSCLC)患者携带突变的KRAS基因(KRASmut)💜,其中KRAS-G12C是肺腺癌(LUAD)中最广泛的突变亚型🐈。组织因子(Tissue factor, TF)在肿瘤的激活可以极大地促进癌症的恶性行为,且在肿瘤微环境(TME)影响治疗结果中扮演着越来越重要的角色。
杏悦余科教授课题组的研究方向之一是组织因子TF-治疗抗体的新药创制及其在肿瘤治疗的作用和机制⛹️♀️,近日在期刊《Oncogene》上在线发表题为“Tissue factor overexpression promotes resistance to KRAS-G12C inhibition in non-small cell lung cancer”的研究论文👌🏻,揭示了TF-mTORC2轴在巨噬细胞吞噬能力的负向调节中的作用,导致免疫逃逸和肿瘤细胞杀伤能力受损。这种影响可以通过TF敲减或TF/mTOR轴的药物靶向来逆转,以达到明显改善抗肿瘤的效果,确定了TF作为KRAS-G12C抑制剂耐药的一个新的和重要的机制。

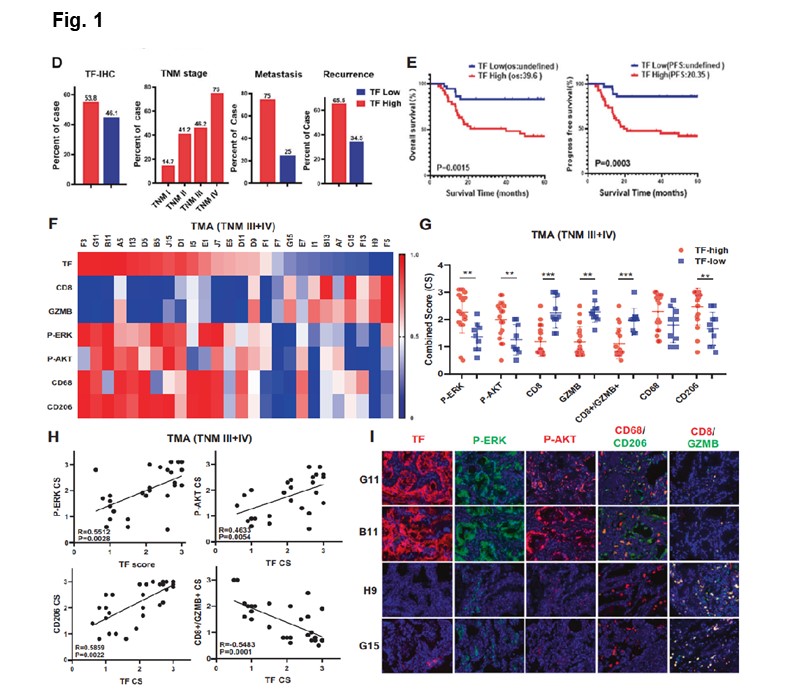
本研究通过分析肿瘤转录组和组织芯片建立了TF与耐药肿瘤的关系🤞🏻,通过采用前期开发的TF抗体HuSC1-39和mTORC1/2抑制剂MTI-31(SCC31)揭示了TF在KRAS突变NSCLC中的功能作用,发现HuSC1-39在体内克服KRAS抑制剂耐药性的功效显著,肿瘤微环境(TME)的重塑可能参与其中🆘。
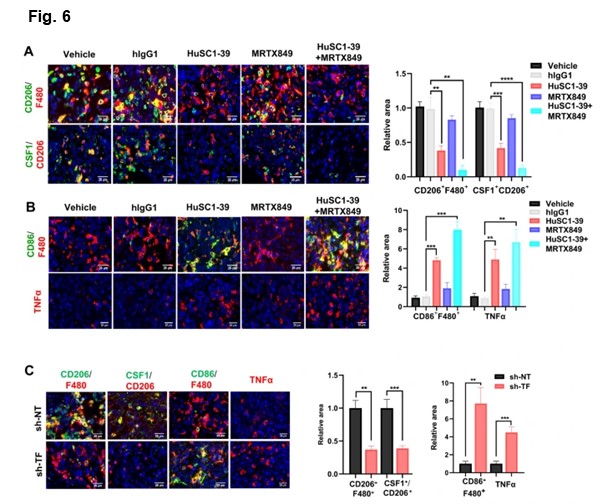
肿瘤微环境中富含肿瘤相关巨噬细胞(TAMs)。大多数TAMs是促进肿瘤生长的M2型巨噬细胞,而抑制肿瘤生长的M1型巨噬细胞则是少数。CSF1是主要由肿瘤产生的因子,负责M2型巨噬细胞的招募。在HuSC1-39或MTI-31处理的肿瘤中🧏🏻,虽然总的巨噬细胞(F4/80+)水平并没有受到很大影响,但M2型巨噬细胞(F4/80+CD206+)和CSF1的数量显著减少,激活的M1型巨噬细胞(F4/80+/CD86+)增加。在TF敲除的肿瘤中也观察到这种促进M1型巨噬细胞的机制。
通过免疫荧光法的展示🙍🏽♀️,HuSC1-39、MTI-31治疗或TF敲除的肿瘤中,TNF-α分泌量显著增加。与MRTX849的联合治疗进一步减少了肿瘤内M2型巨噬细胞,表现出更强的M1型巨噬细胞表型🍛,并具有最高水平的TNF-α🛴。综上所述,HuSC1-39和MTI-31通过改变M2/M1巨噬细胞比例和激活M1型巨噬细胞功能来克服KRAS抑制剂的耐药性。
杏悦2019级博士生张宇为本文的第一作者🧛🏽♂️,杏悦余科教授为本文的通讯作者🥵。该研究获得国家自然科学基金🂠、国家科技支撑计划重大项目🐞⚫️、科技成果转化等基金的资助。
原文链接:https://www.nature.com/articles/s41388-023-02924-y


